更低成本原料创新应用-CRISPR检测新方法
黄曲霉毒素B1(AFB1)是一种主要由黄曲霉和寄曲霉产生的I类致癌物,被认为是农业和食品中常见的主要霉菌毒素。AFB1由于其高热稳定性而难以降解。此外,摄入受AFB1污染的食品引起的致癌、致突变和致畸疾病已成为全球公共卫生问题,因此,快速和准确地检测AFB1非常重要。
目前,传统的分析方法主要包括色谱、色谱/质谱、免疫分析等。虽然这些技术在准确度和重复性方面表现出优势,但它们存在操作繁琐、灵敏度低、劳动强度强、不适合现场检测等缺陷。因此,对高效、快速和可现场检测AFB1的需求正在增加。
CRISPR检测可以解决上述问题,是一种高灵敏度、快速、操作简便的检测方法,艾迪基因自主研发的CRISPR检测原料和技术,可以实现真正的POCT技术。
基于CRISPR/Cas12a视觉检测黄曲霉毒素B1原理
华南理工大学食品科学与工程学院提出了一种基于CRISPR/Cas12a切割G-四链体DNAzyme的多模态生物传感器来检测AFB1。该方法适用于天然污染花生样品的视觉检测,在食品工业中具有广阔的应用前景。

1. 检测过程
该CRISPR检测涉及三个过程:目标识别、G4的反式切割和信号输出。AFB1与适配体的特异性结合占据了互补DNA(cDNA)的结合位点,然后cDNA激活Cas12a,将G4切割成片段。同时,完整的G4-DNAzyme可以催化四甲基联苯胺(TMB)形成着色/SERS/荧光信号增强的TMBox,TMBox在酸性条件下产生的黄色溶液可以与智能手机结合用于视觉检测。可用于花生、玉米和巴丹样品中的AFB1的检测。
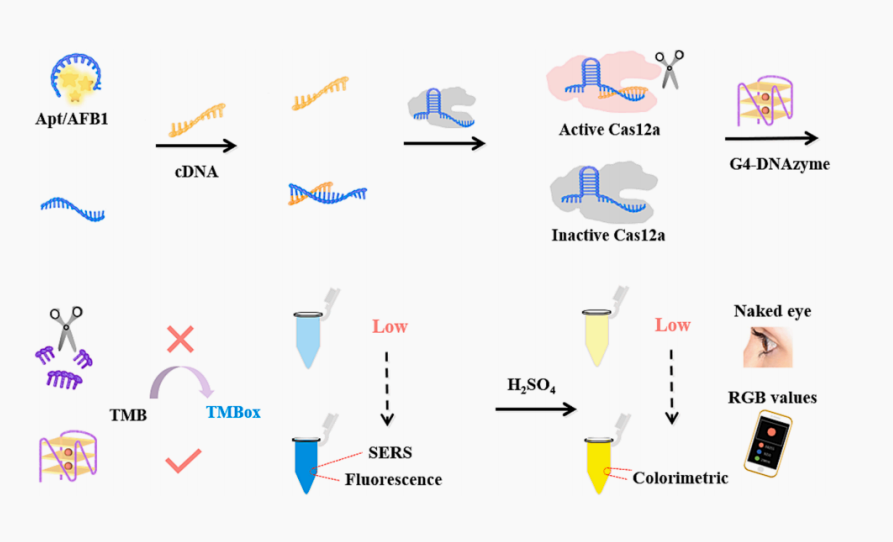
图1.CRISPR/Cas12a切割G4-DNAzyme检测黄曲霉毒素B1原理
2. Cas12a结合G4-DNAzyme生物传感器的显色系统和裂解反应的可行性。
显色系统的影响参数:选择一种CRISPR/Cas12a裂解的缓冲液与G4-DNAzyme兼容的缓冲液是至关重要的,在缓冲液(Mg2+ + K+)溶液中观察到最大荧光强度(图B)。同时使用CD光谱进行了测试证明了G4在该缓冲液中也能成功形成了二级结构(图C)。证明缓冲液(Mg2+ + K+)溶液在Cas酶裂解和G4的二级结构形成中都是兼容的。
进一步验证了体系中的Cas12a、cDNA和crRNA成分是否会影响显色反应,cDNA和crRNA均不能抑制显色系统,而Cas12a通过还原剂二硫苏糖醇(DTT)轻微抑制显色过程,但所形成的颜色足以进行肉眼观察(图D)。说明体系成分对显色系统的显色行成是没有影响的。
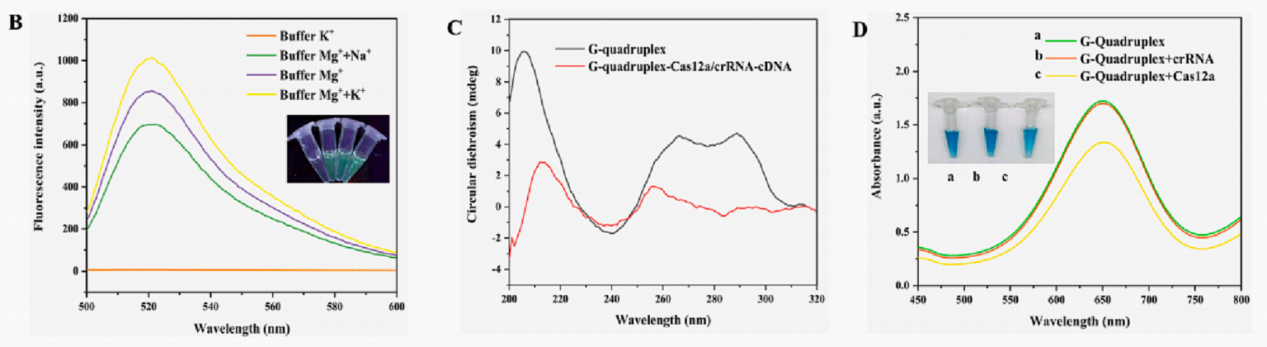
图2. 不同缓冲液对Cas12a对FQ-ssDNA反式切割的影响 (B);Cas12a 对G4的裂解和G4的CD光谱(C);G4-DNAzyme催化显色体系与CRISPR/Cas12a裂解体系的相容性研究(D)
G4体系裂解的可行性分析,在加入结构完整G4时,荧光强度增加。当Cas12a/crRNA和cDNA同时存在时,由于激活的Cas12a切割G4,荧光强度急剧下降(图F)。说明G4被降解为片段,G4片段不能催化显色反应(图G)。证明了基于G4-DNAzyme的CRISPR/Cas12a生物传感器进行AFB1检测的可行性。
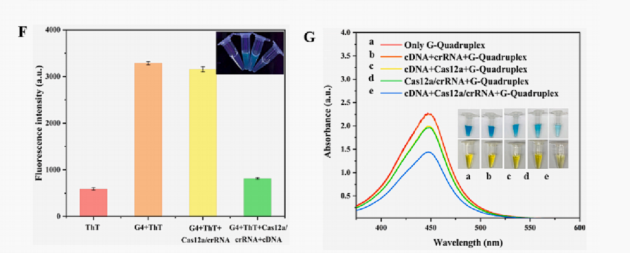
图3. 完整和裂解的G4存在下ThT的荧光强度(F);基于G4生物传感器的荧光可行性验证(G);
3. 实验条件的优化
为了最大限度地提高基于FQ-ssDNA报告基因的传感器的检测性能,选择不同浓度的Cas12a、crRNA和FQ报告基因进行荧光实验(图3A-3C),选择最强的荧光信号对应的浓度。为了降低背景信号,优化了适配体与cDNA的浓度比,当适配体与cDNA的比例为13nM-15nM时,观察到最强的荧光强度(图D)。在基于G4-DNAzyme的传感器中,系统的优化参数参考了上述荧光实验中的优化结果。
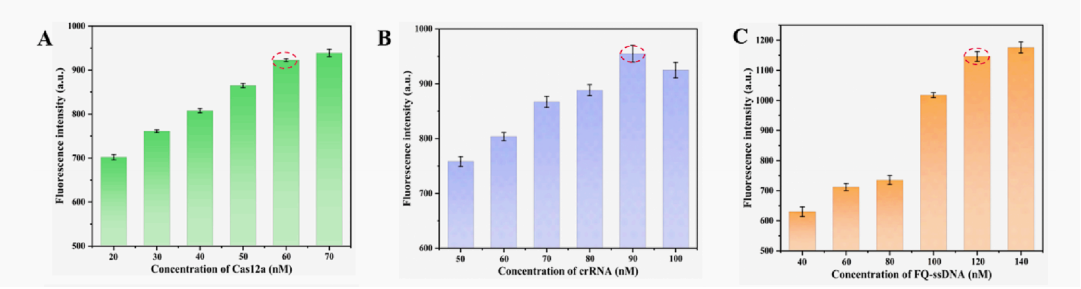
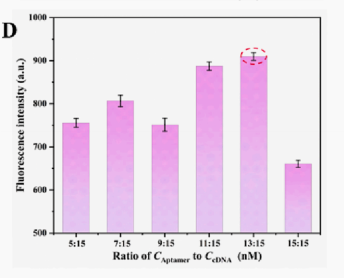
图4. 不同浓度的Cas12a,cDNA,ssDNA(A-C));适配体与cDNA的浓度比(D)
4. 基于CRISPR/Cas12a的多模态生物传感器的检测性能分析
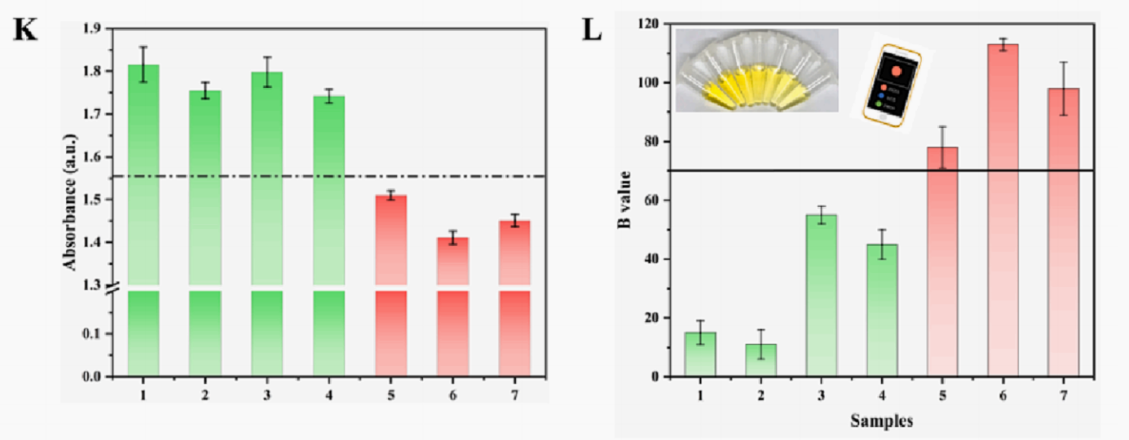
稳定性评估,我们使用AgNPs检测相同浓度AFB1下传感器的拉曼强度一周,SERS信号在7天内基本稳定。研究了G4-DNAzyme的Cas12a生物传感器的稳定性。将制备的7个AFB1反应溶液保存在4℃下,并连续7天记录相同浓度AFB1的紫外-可见吸收信号。紫外-可见吸收强度的下降趋势不明显,说明该生物传感器相对稳定(图K-L)。
灵敏度分析,SERS和荧光标准曲线呈线性关系(图D和F)。SERS和荧光模式的LODs分别低至0.79pg.mL−1和1.65pg.mL−1,表明当前检测平台在AFB1检测中的应用潜力。
特异性分析,通过检测空白对照、AFB2、AFG1、AFG1和三种毒素的混合物,验证该多模态生物传感器的抗干扰能力。实验组的信号的AFB1都显著增强(图H-J),而三个干扰组和空白组几乎没有变化,这说明多模态传感器平台具有良好的特异性。
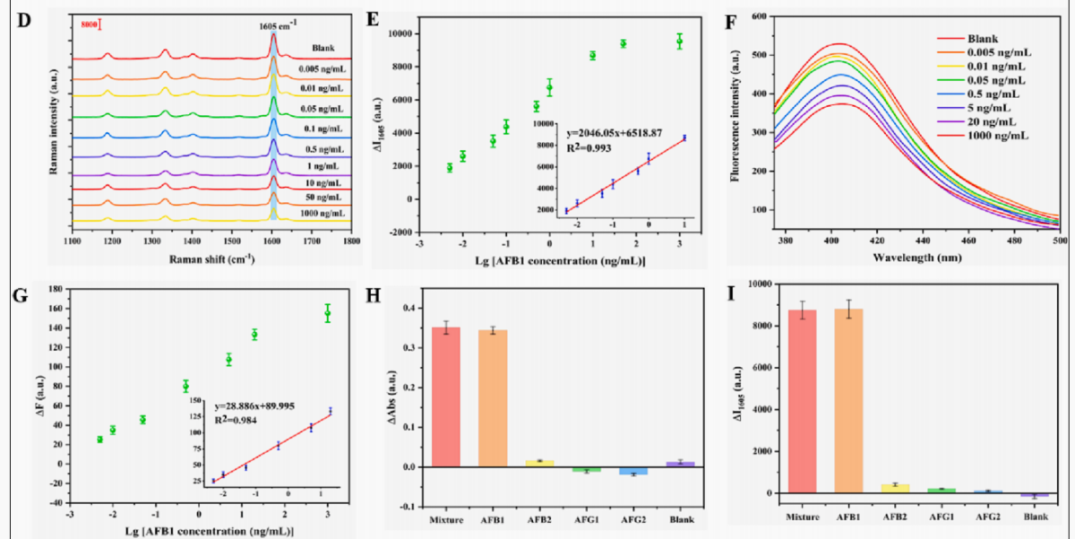
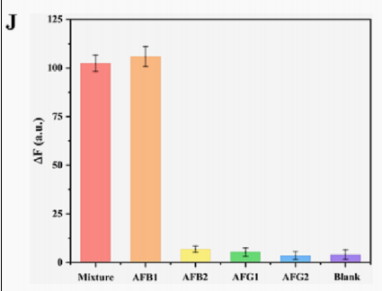
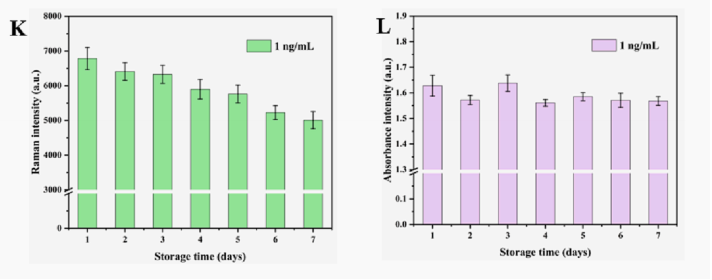
图6. 不同浓度AFB1的SERS光谱 (D);SERS强度与AFB1对数浓度的线性关系(E);不同浓度AFB1 的荧光光谱(F);荧光强度与AFB1对数浓度的线性关系(G);生物传感器对不同干扰物的表现(H-J);AgNPs底物和所开发的生物传感器在7天内的稳定性(K-L)
5. 真实样本检测中的应用
为了证明该方法在真实样品中的应用,首先用胶体金基AFB1检测卡对7份被AFB1自然污染的花生样品进行了检测(图M),其中4份为阳性,3份为阴性,随后,根据设计的生物传感器对7个样品进行了评估,由紫外-可见吸光度结果表明,该传感器在实际应用中是可行的(图K-L)
![]()
图7. 用紫外-可见光谱定量测定真实花生样品中的AFB1(K);通过智能手机中应用程序识别的B值验证筛选出的阴性和阳性样品(L);7个花生样品的胶体金快速检测卡快速筛选结果(M)
总结
综上所述,本文提出了一种基于CRISPR/Cas12a结合G4-DNAzyme检测AFB1的新型检测模式。AFB1触发了Cas12a对G4的裂解,导致G4-DNAzyme的过氧化物酶活性缺失,因此,传感器平台的紫外-可见吸光度、荧光和SERS强度发生了显著变化,着色信号可以通过智能手机的应用程序多信号输出传感器检测范围广,检测限低。AFB1和适配体之间的结合确保了靶标的有效识别,Cas12a的侧切活性放大输出信号,以G4-DNAzyme作为报告降低了检测成本。为未来CRISPR检测的带来了创新。
艾迪基因可提供上述研究中使用的Cas12a酶及配套的所有产品和技术服务,经实验验证,艾迪基因提供的Cas12a酶性能明显优于市面上其它品牌,欢迎联系我们:18102225074(微信同号),免费领取试用装。
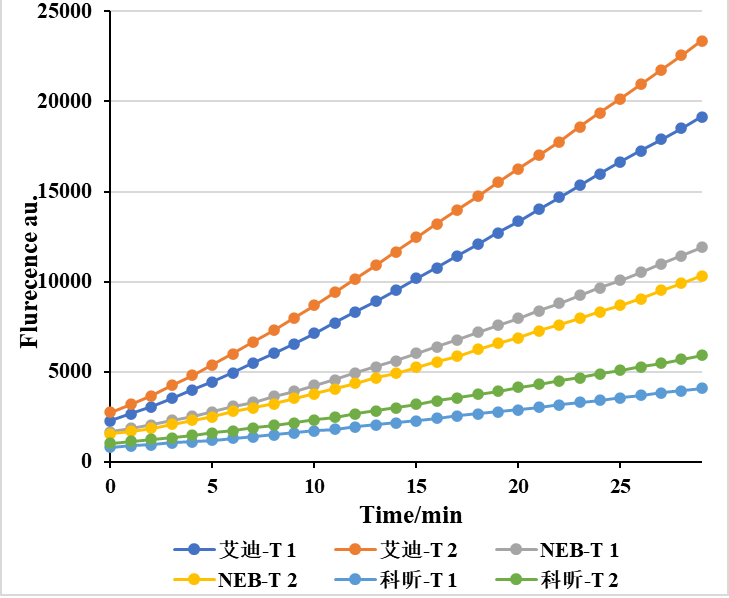
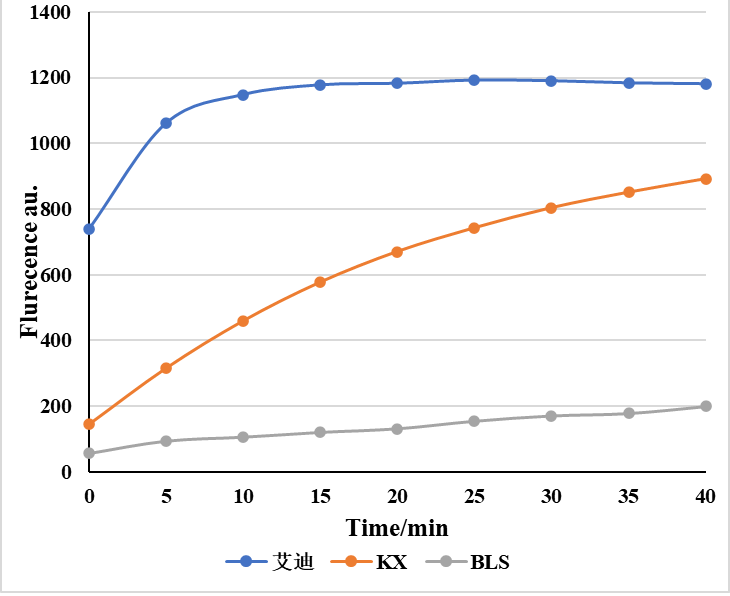
LbCas12a活性对比 lwaCas13a活性对比



