【前沿资讯】CRISPRa文库筛选助力肝癌研究发现新靶点
华南理工大学、暨南大学和华中科技大学等高校研究人员在iScience上发表题为CRISPR activation screening in a mouse model for drivers of hepatocellular carcinoma growth and metastasis的研究论文,在该研究中使用CRISPR激活(CRISPRa)SAM2慢病毒文库筛选肝细胞癌全基因组生长和转移驱动因子,为体内筛选与肝肿瘤侵袭转移相关的功能基因提供了路线图。

原发性肝癌是世界上第六大最常见的恶性肿瘤,其中肝细胞癌(HCC)是最常见的原发性肝癌,占全部病例的90%,了解肿瘤转移背后的生物学和遗传学基础将有助于设计有效的临床干预策略,降低肝癌的死亡率。在本研究中,研究人员通过CRISPRa对原发性肝肿瘤生长和转移过程中的功能获得性筛选进行了系统的表型测量,确定了促进细胞增殖和侵袭的候选靶点XAGE1B、PLK4、LMO1和MYADML2。
研究人员在8个独立的感染重复实验中,用CRISPR/Cas9 SAM2 pooled library转导HEPG2细胞,将43106个细胞体外培养1周后移植到免疫受损的BLAB/c Nu/Nu小鼠肝脏中构建原位肿瘤模型,对小鼠模型进行了功能获得转移筛选。结果显示SAM2文库转导小鼠的体重和存活率均低于对照组,肉眼观察下SAM2文库转导和未转导的HEPG2细胞均在注射部位形成肿瘤。此外,SAM2转导小鼠肝脏中VEGF、Vimentin和MMP9蛋白的表达水平显著升高,SAM2转导小鼠的肺中VEGF和MMP9蛋白的表达水平较高。这些结果表明SAM2文库转导增强了HEPG2细胞在肺内形成转移的能力。
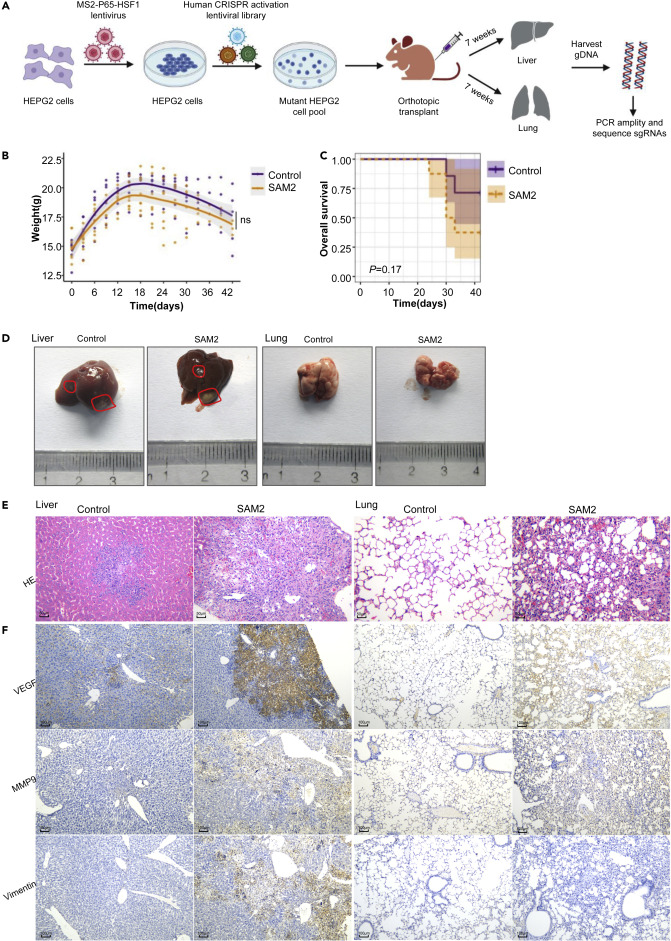
图1 肿瘤在SAM2文库移植的HEPG2细胞中的生长和转移
研究人员取肝、肺基因组中的sgRNA序列进行PCR扩增,通过高通量测序计算sgRNA在细胞中的覆盖率,比较肺和肝的归一化sgRNA丰度差异。结果显示,H型基因肺中sgRNAs的丰度高于肝脏,是肺转移的特异性基因;C型基因可能促进肿瘤生长和肺转移;L型基因sgRNAs的丰度小于肝脏,可能主要促进肿瘤生长而非转移。通过KEGG通路分析进一步分析这些基因,H型基因普遍差异表达的sgRNAs富集在细胞粘附分子(CAMs)、Notch等细胞中,C型基因与代谢、PI3KAkt、肌动蛋白细胞骨架调控、MAPK、FoxO信号通路等相关,L型基因提示他们参与了VEGF、紧密连接、细胞周期、肿瘤通路中的转录调控异常等。
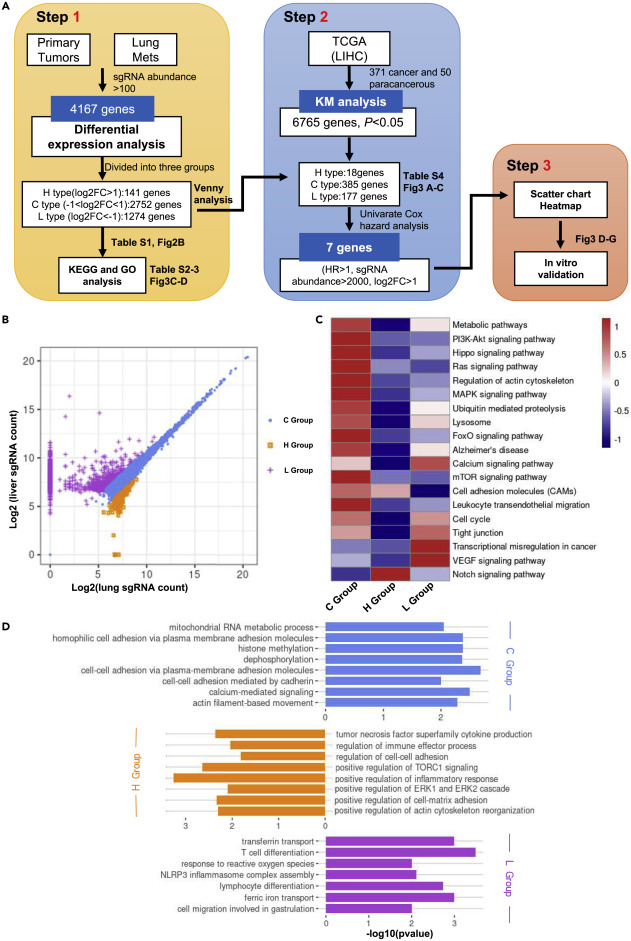
图2 sgRNA文库筛选确定影响肝脏和肺脏肿瘤生长和转移的途径
研究人员对421个样本进行Kaplan-Meier分析,在TCGA的6765个基因中与C组有385个基因相交,与L组有177个基因相交,与H组有18个基因相交。火山图显示相交的580个肝癌基因的差异分析,代表了371个癌症样本和50个癌旁样本的比较以及50对匹配的HCC和癌旁比较。在原发性肝肿瘤和肺转移瘤中鉴定富集基因,筛选出影响肿瘤生长和转移的7个基因(POLR2L、XAGE1B、HOXD1、PLK4、C17orf99、LMO1和MYADML2)。
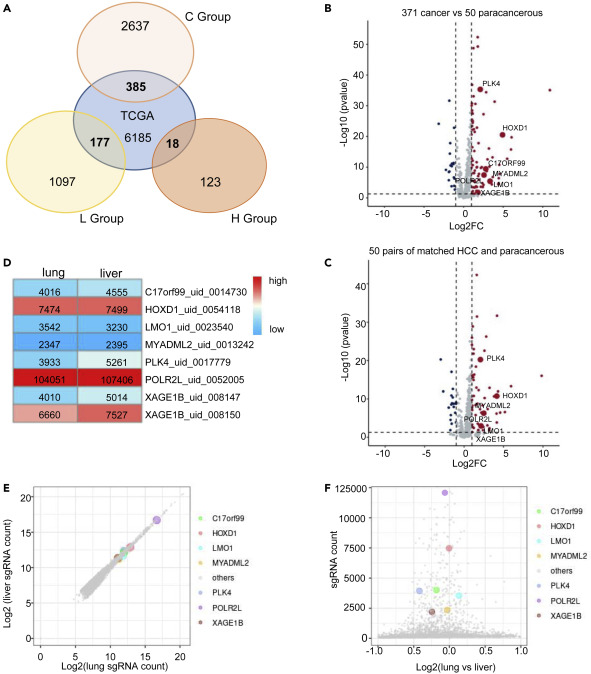
图3 CRISPRa筛选肝脏肿瘤生长和转移的基因组中富集的sgRNAs
研究人员使用慢病毒运载CRISPRa的POLR2L、XAGE1B、HOXD1、PLK4、C17orf99、LMO1和MYADML2以及对照组感染肝癌细胞株HEPG2和huh7,以验证CRISPRa文库筛选出的候选基因对HCC细胞表型的影响。q-PCR证实所有sgRNA序列均能在HEPG2和HUH7细胞中有效上调七个候选基因的表达。CCK8检测显示,过表达七个候选基因均可显著促进HCC细胞增殖,增加了肝癌细胞的存活率。将七个候选基因高表达的细胞进行细胞侵袭实验,所有被测基因侵袭HEPG2细胞数量均显著增加,与对照组相比差异极显著,其中过表达LMO1、MYADML2、PLK4和XAGE1B显著促进Huh7细胞侵袭,表明这些基因加速HCC细胞的侵袭。

图4 候选基因的过度表达促进了肝癌细胞的增殖和侵袭
研究人员使用WB检测蛋白表达水平,筛选出抑制效果最好的siRNA,用CCK8和Transwell检测细胞增殖和迁移。结果显示,下调LMO1、MYADML2、PLK4和XAGE1B可在24h、48h和72h显著抑制HCC细胞增殖,Transwell实验清楚地显示,与HEPG2和Huh7细胞的siNC组相比,LMO1、MYADML2、PLK4和XAGE1B-siRNA组在48h时的侵袭细胞明显减少。

图5 抑制候选基因表达可抑制肝细胞癌细胞的增殖和侵袭
研究人员使用癌症基因组图谱RNA测序数据了解这些候选基因在HCC中的表达谱,并在TCGA数据库中评估这些候选基因的表达水平。结果显示,LMO1、MYADML2、PLK4和XAGE1B高表达的HCC患者的总生存期较低表达的患者较差,单因素分析表明LMO1、MYADML2、PLK4和XAGE1B为肝癌患者生存的有价值的预测因子。采用免疫组化方法检测80例HCC组织中MYADML2蛋白的表达,发现MYADML2主要位于胞浆和细胞膜上。Kaplan-Meier分析显示MYADML2蛋白水平高的HCC患者的总生存期比MYADML2蛋白水平低的HCC患者差。表明LMO1、MYADML2、PLK4和XAGE1B的高表达不仅导致了肺转移发生率的升高,而且还影响了肝癌的预后,MYADML2是最重要的预后因素。

图6 使用癌症基因组图谱和免疫组化方法分析候选基因
研究人员对TCGA数据集中的15种免疫细胞类型进行比例分析,发现PLK4、LMO1和MYADML2与M0巨噬细胞浸润水平一致,PLK4与树突状细胞浸润水平一致。此外,PLK4和MYADML2与单核细胞、naive B细胞、M2巨噬细胞的浸润水平呈负相关,提示树突状细胞、巨噬细胞、B细胞等在促进HCC增殖和侵袭中发挥重要作用。

图7 肝癌免疫细胞组成分析
综上所述,研究人员使用CRISPRa文库筛选技术为在体内筛选与肝肿瘤侵袭转移相关的功能基因提供了路线图,筛选出的LMO1、MYADML2、PLK4和XAGE1B基因高表达不仅意味着更高的肺转移概率,而且还影响了肝癌的预后,这些发现为肝癌的临床诊断、治疗和预后评估提供了新的潜在的生物学靶点。
Get同款!艾迪基因提供上述研究中使用的CRISPRa文库,覆盖度≥99%,均一度<10,还有90+种文库质粒/病毒等你来挑!现货一周送达~
近期资讯
Prime Editing点突变细胞构建实验流程及应用常见问答
【干货分享】CRISPR检测新动向-CRISPR/Cas12a单管检测猴痘病毒
【前沿资讯】Prime Editing新动向-点突变细胞助力基因治疗临床前研究
联系我们
18102225074(微信同号)
market@edgene.cn



