【文献解读】CRISPR KO筛选揭示了化疗耐药性的关键基因

今年六月,东北大学生命科学与健康学院费腾教授领导的研究团队,联合中山大学附属第六医院结直肠外科黄俊教授和北京大学临床医学高等研究院/北京大学肿瘤医院吴华君教授的课题组在《Nature Communications》杂志上发表了题为“CRISPR screens reveal convergent targeting strategies against evolutionarily distinct chemoresistance in cancer”的研究论文。这项研究利用30套全基因组CRISPR基因敲除筛选以及26套成药基因文库筛选,系统地鉴定了多种肿瘤细胞对于7种常见化疗药物的化疗耐药相关基因,成功揭示了癌症细胞对多种化疗药物产生耐药性的分子机制,并为未来的癌症治疗提供了新的策略。

一、基因组规模的 CRISPR 化疗耐药基因筛选
研究人员为了系统地鉴定功能丧失驱动癌症化疗耐药性的基因,通过CRISPR基因敲除筛选技术,在结直肠癌、乳腺癌和肺癌细胞中,评估了七种常用化疗药物的效果。利用慢病毒载体将Cas9核酸酶和sgRNA转导到细胞中,这些sgRNA靶向人类基因组中的18,436个蛋白质编码基因。研究结果表明,对于没有选择压力载体(DMSO)处理筛选,核心必需基因表现出强烈的负筛。各药物施加了不同的选择压力,通过基尼指数和sgRNA计数的分布匀一性来评估。使用MAGeCK计算RRA评分来量化基因敲除的影响,负值较低表示更强的负选择,正值较高表示更强的正选择。“化学耐药基因”被定义为那些功能丧失使筛选细胞对化疗药物产生耐药性的基因,并且可以从阳性筛选的命中中拉出,该基因的功能本身可能会抑制或抑制化学耐药性。
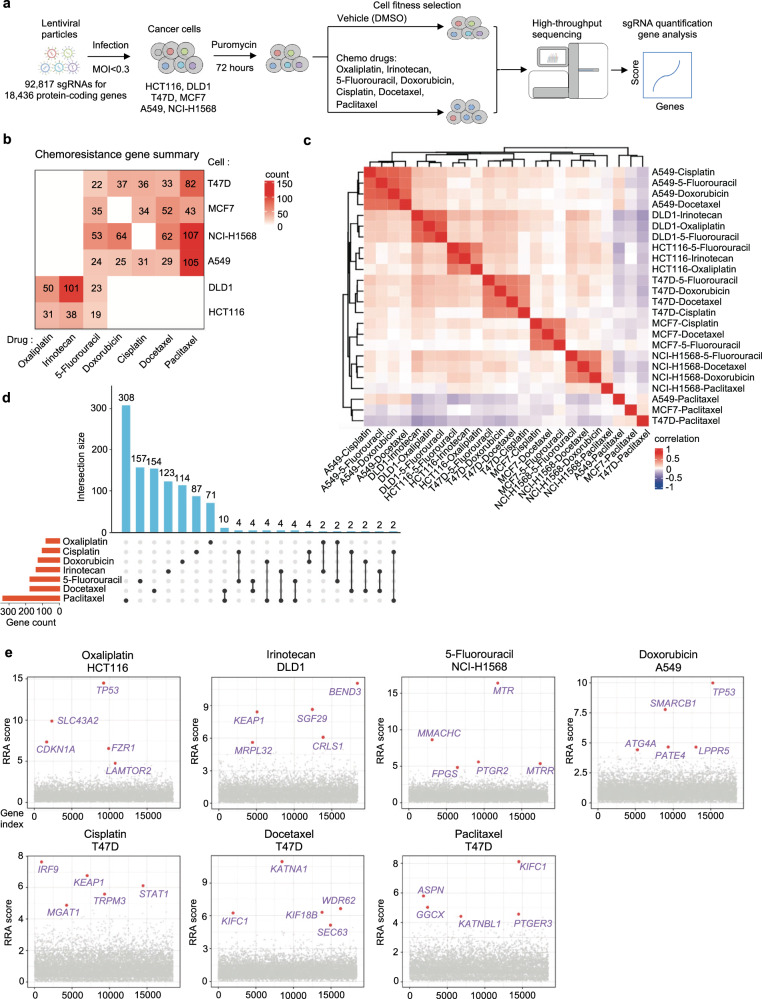
图1 化学抗性基因的基因组规模鉴定
二、化学耐药性遗传图谱的系统视图
通过对多种癌症细胞系进行CRISPR敲除筛选,研究人员识别了数十个与不同化疗药物耐药性相关的基因。结果分析表明,这些化学耐药基因主要通过细胞来源而非药物类型聚集,显示了遗传背景在决定化疗耐药性中的重要性。虽然不同细胞系中化学耐药基因有所重叠,但大多数耐药基因在细胞特异性上表现出差异。研究人员进一步通过跨细胞系的结果整合,生成了药物特异性的耐药基因列表,揭示了细胞遗传背景和药物机制如何影响耐药基因的变异。进一步的功能富集和网络分析揭示了细胞周期、DNA损伤反应和成纤维细胞增殖调节等功能在多药耐药性中的作用,同时特定的线粒体相关机制与伊立替康耐药性密切相关。这些数据系统地提供了关于化学耐药性如何在基因或通路水平上发展的机制见解。
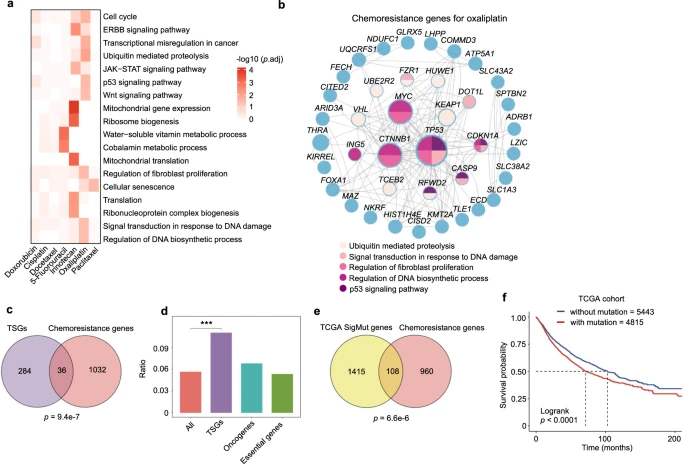
图2 化学抗性基因的系统视图
三、化疗耐药基因的临床相关性
为了探讨体外筛选鉴定的化学耐药基因与人类临床数据之间的关联,研究人员首先分析了化疗耐药基因与肿瘤抑制基因(TSG)之间的关系,因为TSG的功能丧失通常与癌症发展相关。利用COSMIC癌症基因普查中的TSG列表,他们发现化疗耐药基因与TSG之间存在显著的重叠,而与致癌基因和泛必需基因无明显关联。虽然已有研究报告了TSG与耐药性之间的联系,如TP53,但该研究系统地验证了TSG在化学耐药性中的重要性。研究人员通过分析癌症基因组图谱(TCGA)的体细胞突变数据,发现许多化疗耐药基因在肿瘤中存在高频突变,且这些基因的突变与患者较差的生存率相关。频繁突变的耐药基因包括已知的药物反应调节因子(如TP53和MED12)及其他未被重视的基因。某些基因的突变或低表达与特定癌症类型的生存率低有关,进一步支持了研究结果的临床相关性。此外,结直肠癌细胞在奥沙利铂治疗后,某些关键耐药基因(如KEAP1、SLC43A2或TP53)的表达水平在复发性肿瘤中显著下调。综上所述,化疗耐药基因的突变特征和/或表达状态可能作为预测化疗反应的潜在生物标志物。
四、通过进化上不同的途径快速衍生化学抗性细胞
研究化学耐药性的典型方法主要是通过直接比较具有不同遗传背景的耐药细胞与敏感细胞,或通过长期药物攻击从敏感的亲本细胞衍生出匹配的耐药细胞。该研究中,研究人员通过直接敲除特定的化学耐药基因,快速且高效地建立了多个化学耐药细胞系。结果表明,不同药物的增敏基因谱各异,且某些药物如伊立替康由于筛选压力未能识别致敏基因。不同药物间共享了更多的致敏基因而非抗性基因,一些关键致敏基因如NEK7、KDM5C、KLF5和BCL2L1在不同药物中重复出现,表明了多药耐药的共同脆弱性。富集分析显示,靶向某些通路的药物可能增强治疗效果。虽然不同细胞系间的致敏基因有所不同,但揭示了耐药性的多样遗传机制,说明需要同时探索多个化学耐药性途径以发现有效的治疗策略。此外,通过基因敲除建立的化学抗性细胞表明,单个基因的缺失可以迅速导致耐药性,无需药物适应。这为巩固了顶级化疗耐药命中的药物反应表型,而且为快速生成多种化疗耐药细胞系提供了宝贵的资源。
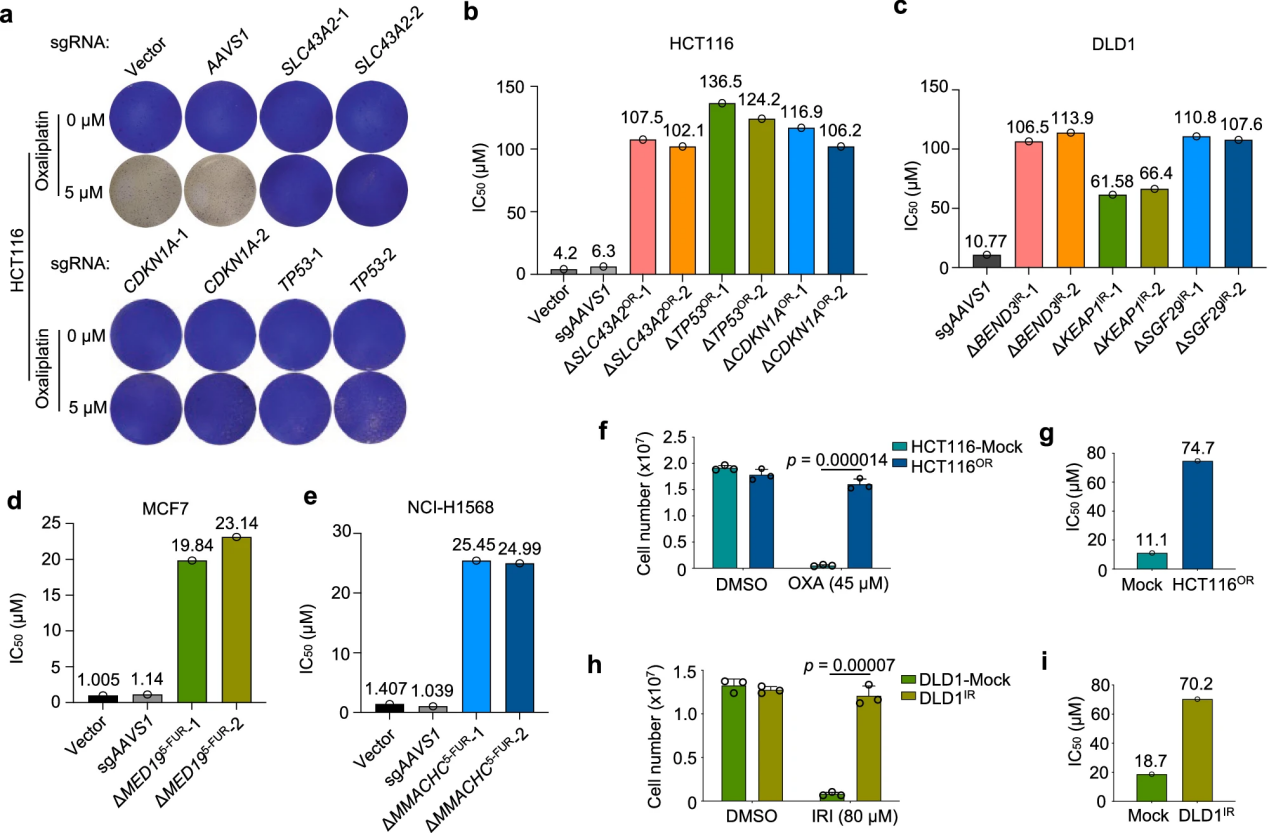
图3 化学抗性细胞的快速衍生
五、化学耐药细胞的细胞特征
通过敲除特定基因或长期药物选择建立的耐药细胞系,研究人员研究了化学耐药性的分子机制。以奥沙利铂耐药性为模型,研究发现不同来源的耐药细胞没有显著的形态变化,也没有显著的生存率下降,但细胞周期分析显示奥沙利铂能显著降低S期细胞比例,并在不同剂量下阻滞细胞周期。耐药细胞通过干扰p53/p21信号通路来抵消这些效应,从而产生耐药性。同时,耐药细胞中ERK信号传导受抑制,但其凋亡率变化不大。类似地,伊立替康耐药细胞表现出类似的耐药特征,但未见ERK信号或其他信号通路的显著变化。这表明,针对这些细胞生长相关激酶的靶向治疗可能不是克服结直肠癌中伊立替康耐药性的有吸引力的选择。
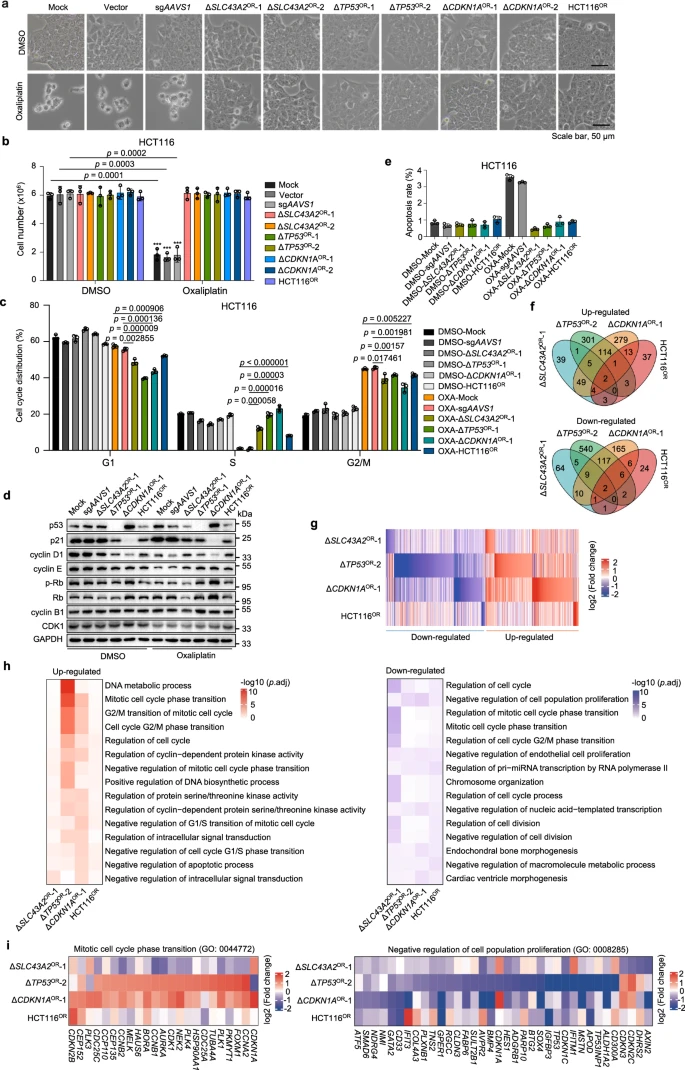
图4 奥沙利铂耐药细胞的细胞和分子特征
六、奥沙利铂或伊立替康耐药性的基因表达特征
为了表征化学耐药性的内在分子特征,研究人员通过RNA测序对多个化学耐药细胞进行了转录组分析,比较了不同抗性模型与敏感细胞之间的差异基因特征。结果发现,不同奥沙利铂耐药细胞之间的基因表达模式存在显著差异,且某些细胞共享更多的差异调控基因,尤其是在p53和p21的调控下。虽然耐药细胞的基因表达谱不同,但细胞周期相关基因在多个耐药细胞系中普遍上调,显示推动细胞周期进程是抵抗奥沙利铂毒性的主要机制。针对伊立替康耐药细胞,发现不同细胞间存在显著的基因集重叠,与细胞骨架组织、细胞周期及DNA损伤反应相关的基因在抗性细胞中上调,表明这些通路对化学耐药性具有重要影响。进一步分析表明,共享的上调基因可能与低生存率相关,而在耐药细胞中,阳性选择的基因趋于下调,增强了这些基因在驱动化学耐药性中的功能丧失效应。
七、第二轮CRISPR筛选可成药靶点
为探索潜在的药物靶点,研究人员构建了一个新的CRISPR敲除文库,包含12,000个靶向人类基因组中1,716个可成药基因的sgRNA。该文库用于筛选基于HCT116的四个奥沙利铂耐药细胞系和两个不同背景的耐药细胞系(DLD1和HCT8)及其敏感对照细胞。通过分析这些数据,发现耐药细胞中选择更负的可成药基因,特别是细胞周期调节因子PLK4,对奥沙利铂耐药性有显著影响。类似地,对伊立替康耐药性筛选发现,线粒体和细胞呼吸相关的基因在耐药细胞中富集。这些结果揭示了不同化学耐药性中的共通脆弱点,并且通过这种方法确定的这些可成药的靶点或途径为应用单药方案来克服化学耐药性提供了一种初步的实用选择。
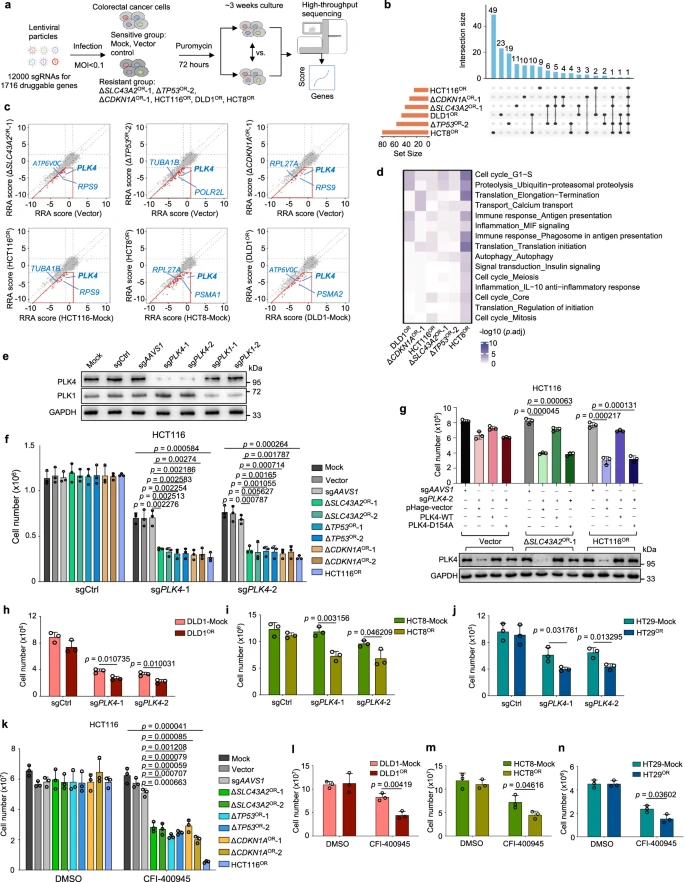
图5 通过第二轮CRISPR筛选对奥沙利铂耐药性的成药靶点
八、奥沙利铂耐药细胞对 PLK4 的选择性依赖性
为了验证靶向策略的有效性,研究人员重点研究了PLK4这一在结直肠癌和奥沙利铂耐药中表现出潜在靶向作用的基因。PLK4编码的丝氨酸/苏氨酸蛋白激酶在细胞周期、中心粒复制及胞质分裂中发挥关键作用,并与多种化疗药物的耐药性相关。
为了探讨PLK4如何在奥沙利铂耐药细胞中发挥其功能,研究人员通过敲除PLK4或其同源基因PLK1,发现PLK4敲除显著降低了七种奥沙利铂耐药细胞系的细胞生长,而PLK1的影响较小。进一步的挽救实验表明PLK4的激酶活性对这一表型的出现至关重要。
为了进一步寻求通过RNA-seq鉴定下游PLK4靶基因,在CRISPR介导的PLK4敲除后,发现不同数量的靶基因,但耐药组和敏感组之间没有显著差异。功能富集分析显示,RNA加工相关基因在PLK4上调靶标中富集,而耐药细胞中的特异性富集则与基础细胞功能相关。研究人员推测PLK4 调节的 中心粒周围材料 在区分奥沙利铂耐药和敏感细胞之间的纺锤体塌陷表型方面可能比中心粒生物发生更关键。
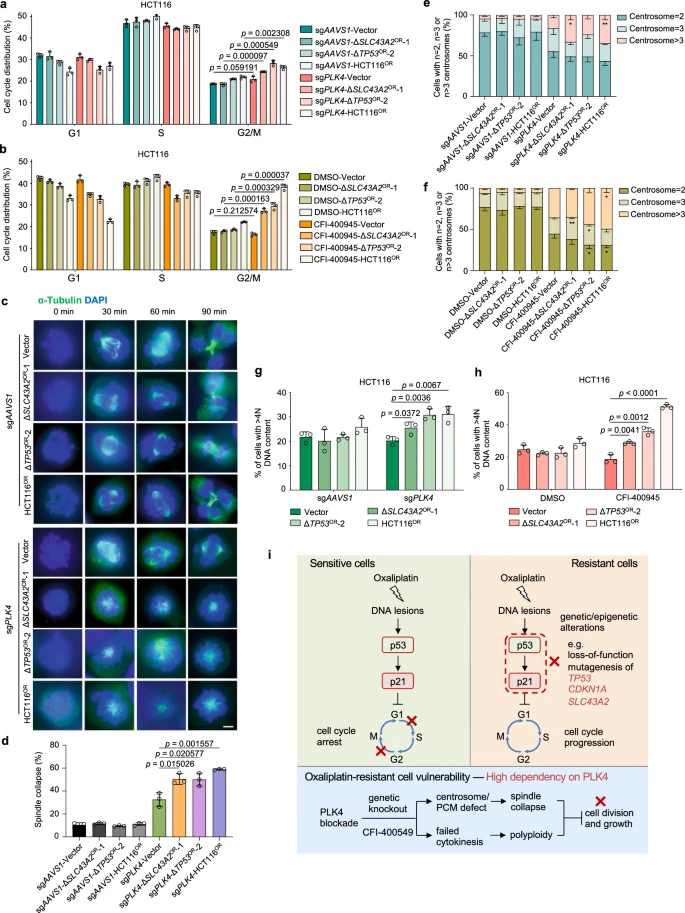
图6 奥沙利铂耐药细胞对PLK4的选择性依赖性
九、奥沙利铂耐药性和 PLK4 依赖性的机制见解
通过包括CRISPR筛选、多种奥沙利铂耐药模型的细胞和分子表征在内的组合努力,初步了解了结直肠癌中奥沙利铂耐药性的机制。在敏感细胞中,奥沙利铂通过形成DNA加合物引发DNA损伤,激活p53-p21通路,从而导致G1和G2/M期细胞周期停滞,阻断细胞生长。然而,一旦细胞发生遗传或表观遗传改变,如TP53或CDKN1A的缺失,细胞周期进程失控,导致耐药性。
此外,虽然药物运输、解毒、DNA修复和细胞死亡等机制也涉及耐药性,研究表明,细胞周期的调控是结直肠癌奥沙利铂耐药性的核心机制。在耐药细胞中,PLK4的功能成为一种关键的脆弱点,因为这些细胞对PLK4依赖性更强,PLK4的缺失或抑制会导致纺锤体组装失败和细胞分裂问题。PLK4的靶向治疗可能为治疗奥沙利铂耐药的结直肠癌创造机会。
十、在异种移植模型和临床样本中靶向PLK4
为了进一步研究靶向 PLK4 拮抗奥沙利铂耐药性的治疗潜力,研究人员在奥沙利铂敏感和耐药小鼠模型中进行了实验,监测了肿瘤生长。结果显示,CFI-400945对奥沙利铂耐药肿瘤的抑制效果显著高于对敏感肿瘤的影响。PLK4在多种癌症,包括结直肠癌中经常发生突变,并且在结直肠癌肿瘤中PLK4的RNA表达普遍增加。研究人员通过建立七种患者来源的类器官(PDO)模型,发现这些模型中的PLK4蛋白水平高于正常组织,且奥沙利铂耐药的PDO对CFI-400945更为敏感。这表明PLK4抑制剂CFI-400945单药给药可能是一种有前途的治疗策略,可以克服结直肠癌中奥沙利铂参与的化疗耐药性。
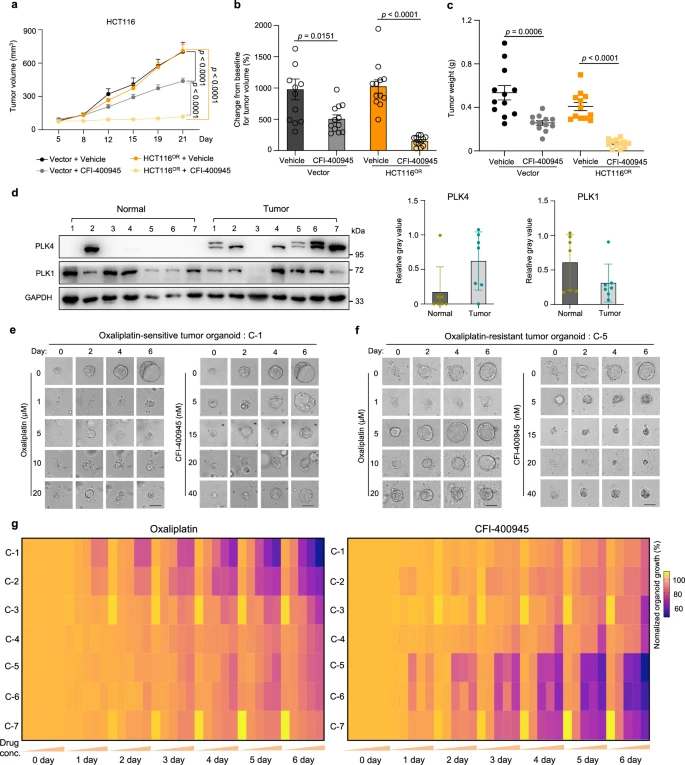
图7 PLK4抑制剂CFI-400945在小鼠和临床水平上对奥沙利铂耐药性的疗效验证
综上,研究人员使用CRISPR KO筛选技术揭示了化疗药物耐药的遗传原因和机制,强调了细胞周期异常、DNA损伤反应及肿瘤微环境重塑等主要驱动因素,并提出了针对这些耐药机制的有前途的生物标志物和治疗策略。这些发现为理解和克服化疗耐药性提供了宝贵的信息,特别是在结直肠癌中验证了PLK4作为奥沙利铂耐药的靶点。
原文链接:https://doi.org/10.1038/s41467-024-49673-4
艾迪基因提供CRISPR文库筛选的一站式完整解决方案,CRISPR KO/CRISPRa/CRISPRi均可提供,还有国内最全文库质粒/ 病毒现货集合,现货一周达,下单即筛!
近期资讯
1.【前沿资讯】CRISPR技术新动态--CRISPR/Cas9基因敲除细胞技术助力开发消融癌细胞新方法
2.【文献解读】CRISPR-Cas12a表现出金属依赖的特异性转换
3.【文献解读】CRISPR KO筛选助力开发眼镜蛇毒液咬伤的潜在解毒剂

联系我们
18102225074(微信同号)
market@edgene.cn



