gRNA——提高CRISPR基因编辑实验效率的关键!
CRISPR-Cas9基因编辑技术就是通过人工设计的 sgRNA(guide RNA)来识别目的基因组序列,并引导 Cas9 蛋白酶进行有效切割 DNA 双链,形成双链断裂,损伤后修复会造成基因敲除或敲入等,最终达到对基因组DNA 进行修饰的目的。
Matthew H Porteus等人在nature biotechnology上发表了Chemically modified guide RNAs enhance CRISPR-Cas genome editing in human primary cells,该研究通过对合成的sgRNA进行化学修饰,提高了人类原始T细胞和CD34+造血干细胞和祖细胞(HSPC)的基因组编辑效率。将化学修饰的sgRNA与Cas9 mRNA或蛋白质共同递送,是一种有效的递送方法,而且不存在与DNA递送相关的毒性。这是一种简单而有效的方法,有促进CRISPR-CAS技术在生物技术和治疗应用方面发展的潜力。

研究内容
为了测试化学合成的sgRNA用于基因组编辑的效用,作者对sgRNA进行三种不同的化学修饰,包含M、MS、MSP,加在5’和3’末端的三个核苷酸上,并评估其的最终效果。作者选择了三个已经被细胞系中具有高基因编辑频率的sgRNA靶向的人类基因:IL2RG,HBB,和CCR5。结果表明,通常情况下,化学修饰的sgRNA保持了高度的特异性。在靶和脱靶比率的差异表明sgRNA的化学变化具有调节活性的可能性。
为了进一步探索化学修饰的人类细胞系中的sgRNA,作者转向一个全RNA递送平台,联合递送sgRNA和编码Cas9的mRNA。并通过核转染的方式联合或连续递送Cas9和各种靶向IL2RG的合成sgRNA,探索化学修饰是否对sgRNA活性的半衰期有影响。之后,作者比较了未修饰和MS修饰的sgRNA在脱靶位点的活性。研究发现,当化学修饰的sgRNA与Cas9 mRNA共同递送或作为RNP递送时,在人类细胞系中显示出比未修饰的sgRNA更具优势的基因编辑。
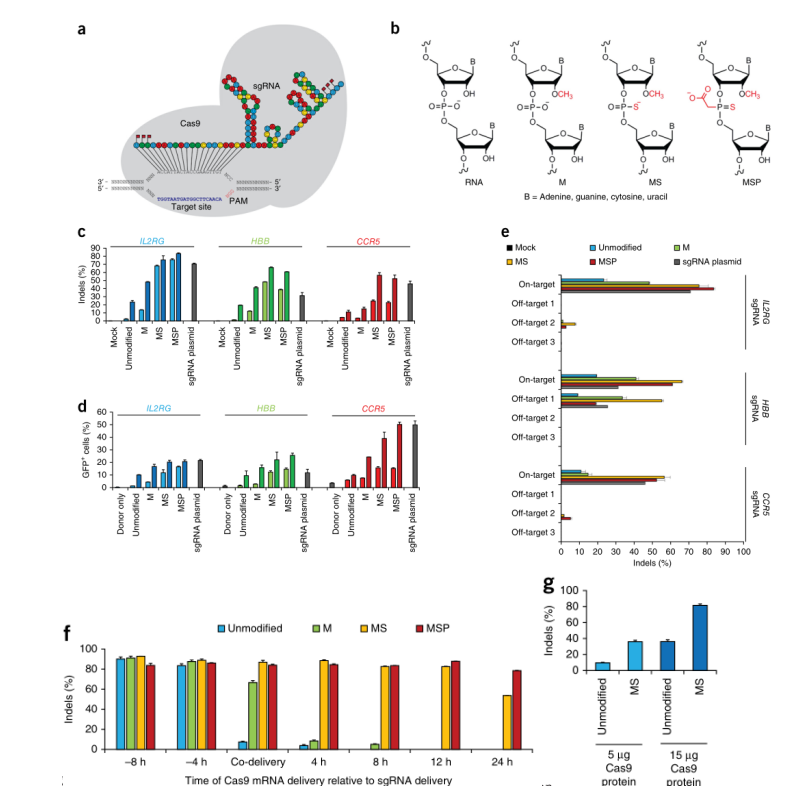
图1 化学修饰合成的sgRNA促进人类细胞系K562中高频率的突变和同源重组(HR)。
接下来,作者在原代细胞中测试了化学修饰的sgRNA,发现与质粒核转染相比,修饰后的sgRNA对细胞存活和增殖的影响很小。还在未受刺激的T细胞中测试了MS修饰的sgRNA,与刺激的T细胞相比,未刺激的T细胞在供者之间表现出更高的变异性。并发现针对IL2RG和HBB的化学修饰的sgRNA在从动员的外周血中分离出来的CD34+HSPC中具有活性。
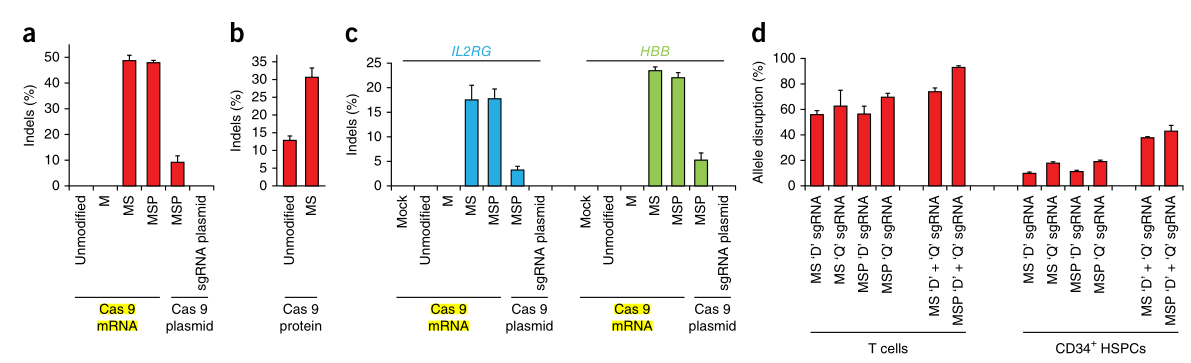
图2 化学修饰的sgRNA促进了人类T细胞和CD34+造血干细胞和祖细胞(HSPC)的高频率基因裂解。
研究结果
在这项研究中,作者证明了化学合成的sgRNA可以有效地用于靶向基因组编辑,并且证明了化学修饰的sgRNA可以显著提高人类原代T细胞和CD34+ HSPC的基因组编辑效率。化学合成和修饰的sgRNA比表达或体外转录的sgRNA更具优势,包括:
(1)提高疗效。
(2)用于生物技术和治疗应用的高纯度sgRNA的稳定和可持续生产。
(3)与通常分别用于sgRNA的质粒表达或体外转录的U6或T7启动子对第一转录核苷酸施加的限制相比,sgRNA设计具有更大的灵活性,
(4)与基于DNA质粒的系统相比,在原代细胞中具有更低的细胞毒性,使一个仅具有高活性的RNA或RNP CRISPR平台成为可能。
艾迪基因
艾迪基因具备丰富的基因编辑经验,为广大客户提供crRNA化学合成/生物合成服务,提高基因编辑效率,满足您的基因编辑需要。除此之外,艾迪基因还提供基因敲除、基因过表达稳转细胞株、CRISPR文库筛选等技术服务,拥有近3800种细胞的现货细胞库,欢迎咨询:18102225074(微信同号)



