文献解读|增强LwaCas13a旁切活性,实现超灵敏核酸检测
CRISPR相关蛋白Cas13因其旁切活性被迅速开发应用于核酸诊断。尽管最近在优化cas13核酸检测系统在方面取得了进展,但要增强cas13的旁切活性依然具有挑战性。
美国莱斯大学(Rice University)与康涅狄格大学(University of Connecticut)的高雪课题组、张毅课题组和高阳课题组合作在Nature Chemical Biology上发表了题为Engineered LwaCas13a with enhanced collateral activity for nucleic acid detection的研究论文。

在这片文章中,作者通过将不同类型的RNA结合域RBD融合到LwaCas13a活性位点附近的独特位点--β-发夹环尖端,以增加其RNA底物结合的亲和力。在没有进行靶标扩增的情况下,通过电化学方法,LwaCas13a变体从非活性病毒和未提取的临床样本中检测到了amol浓度的SARS-CoV-2基因组。结果显示了这种方法在临床、生物学和环境重要性,以及RNA靶点超灵敏检测方面的潜力。
01融合RBD到LwaCas13a的N端或C端
作者选择了7个具有不同结构的RBD,RBD通过一个XTEN连接器连接到LwaCas13a的N端或C端,最终得到14个RBD融合体,测试了他们对SARS-CoV-2 N基因片段的旁切活性,比较WT和RBD融合体在30分钟内产生的荧光信号,结果显示,RBD# 4N和RBD# 6N分别增加了75.8%和32.5%的荧光信号。而其他RBD融合体产生的荧光信号都与WT相似或小于WT。随后,作者合成了LwaCas13a的结构模型,该模型表明LwaCas13a的N端可能埋藏在crRNA结合裂口内,而C端可能非常靠近蛋白质的催化中心。因此,将RBD连接到N或C端可以破坏Cas13a折叠或活性位点配置,这解释了为什么14个RBD融合体中有9个导致活性降低。
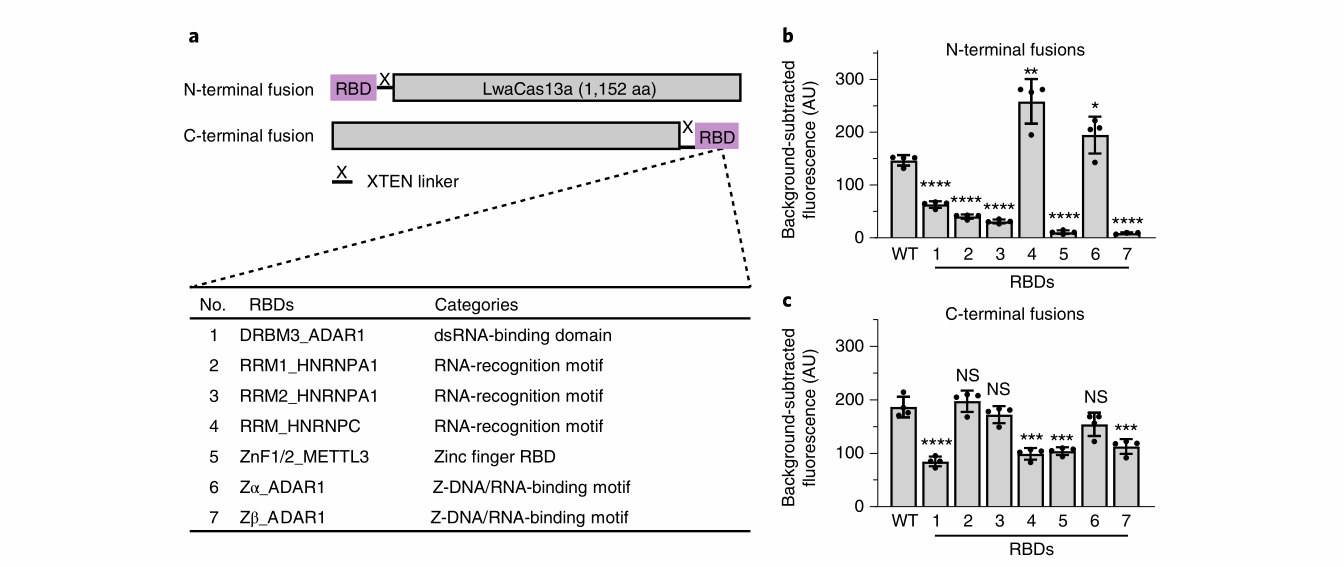
图1 LwaCas13a N端和c端RBD融合体的设计
02识别Cas13a的特殊活性位点用于RBD插入
作者在HEPN1结构域中发现了一个独特的β-发夹环 (Loop 1),作者推测,Loop 1可能是RBD正确定向的最佳插入位点,将选择的7个不含有连接子的RBD直接插在在Loop1顶端的N415和N416残基之间,并使用与图1相同的条件测试融合蛋白的旁切活性。检测结果显示,5个Loop1 RBD融合体的荧光信号比WT高59%、216%、468%、518%和174%。作者还测试了不同插入位置时的旁切活性,结果表明在氨基酸残基N415和N416之间的插入RBD# 3L和#4L在所有测试的插入位点中表现出相当或更高的旁切活性。此外,在同一位置插入含有连接子的RBD,并不能进一步提高旁切活性。相比之下,RBD# 3和#4插入在LwaCas13a的HEPN2域内的另一个活性位点Loop 2, 导致侧枝活性完全丧失。
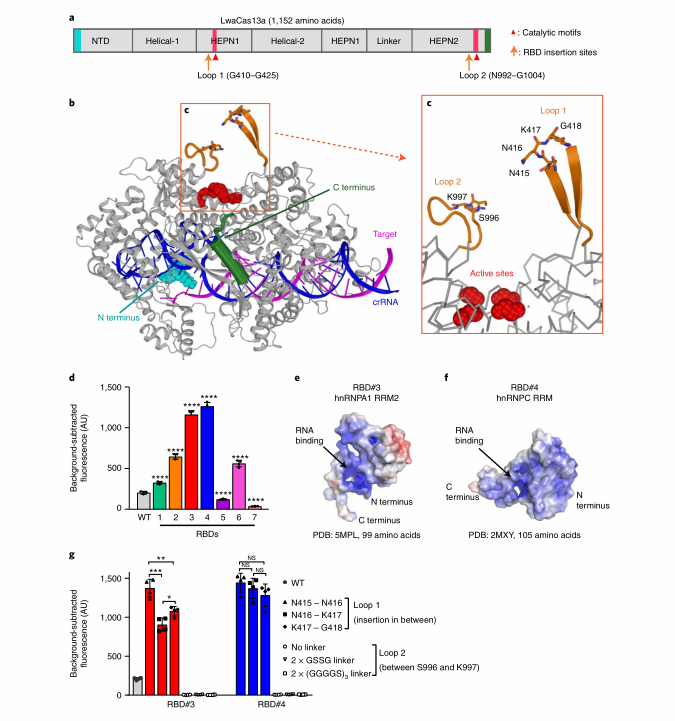
图2 具有增强旁切活性的RBD-LwaCas13a融合蛋白结构指导设计
03报告基因长度影响旁切活性
作者用6-FAM标记的聚U报告基因(分别含有5、11、15和20个核苷酸)测试了RBD# 3L、RBD# 4L和WT的侧枝活性。结果显示RBD# 3L、RBD# 4L和WT均报告基因切割增加,且与报告基因长度呈依赖关系。对裂解产物的密度分析显示,在使用U11、U15或U20的反应中,RBD# 3L、RBD# 4L比WT有更好的侧枝切割能力。通过使用U5、N7和U11报告基因进一步量化了RBD# 3L、#4L和WT的裂解活性。当使用N7时,三种蛋白的荧光强度和切割率最低,可能是由于LwaCas13a的U-U偏好。使用U11报告基因时,三种蛋白的初始切割率分别是U5报告基因的1.5、4.7和5.8倍。
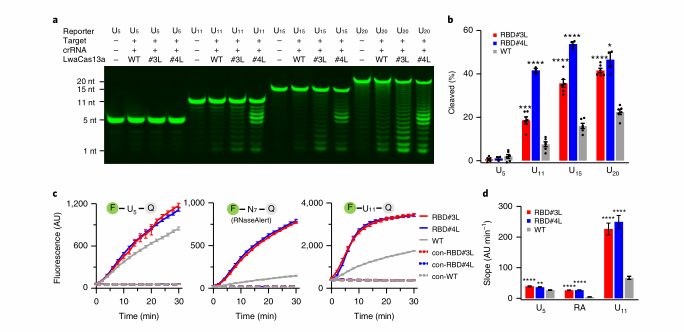
图3 优化报告基因长度提高旁切活性
04进一步评估RBD#3L和RBD#4L的旁切活性
作者使用了ssRNA1靶标的11个crRNA进行了无偏倚测试,RBD# 3L和#4L在120分钟内所有位点的侧支活性均增强,两种RBD融合体在前30分钟产生的荧光信号比WT信号高2.6- 13.4倍,平均增加5.3倍。为了测试蛋白的特异性,作者在28个核苷酸合成的SARS-CoV-2 N基因靶标中每两个核苷酸引入单突变(MM),或在每四个核苷酸引入连续双突变(DM)。对比靶标产生的荧光相对变化,发现荧光信号并没有显著差异,表明RBD#3L和#4L保持了LwaCas13a的特异性。
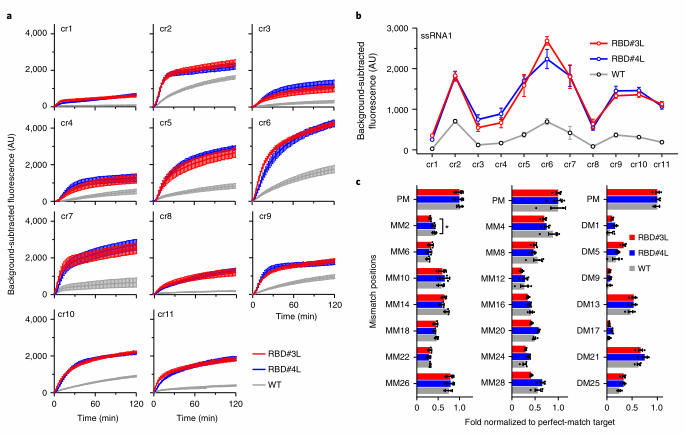
图4 RBD#3L和#4L以间隔独立的方式增强侧枝活性,并保持特异性
05使用cas13变体检测不同的靶标
作者使用RBD#3L和#4L检测SARS-CoV-2, Zika, Dengue, Ebola viruses,和两个短microRNA靶标,来评估LwaCas13a变体的更广泛应用。来自生物流基质的污染通常会降低CRISPR检测的灵敏度。为了模拟从其诊断样本的复杂成分,在检测SARS-CoV-2 N基因靶点时,在反应缓冲液中单独添加8%的介质(VTM)或8%的唾液,WT的活性降低了40%,而RBD# 3L和RBD# 4L的活性与之相当或略有增加。分别在含有8%尿液、2.5%血清或2.5%血浆的反应中检测到寨卡病毒、登革热病毒和埃博拉病毒RNA靶点。WT显示出高达68%的信号减弱,而RBD# 3L和#4L显示出相对于WT的2.5- 6.7倍的信号。同样,在含有2.5%血清或2.5%血浆的反应中,miR-19b靶标和miR-2392靶标的RBD# 3L和RBD# 4L侧支活性相对于WT也表现优秀。总的来说,在复杂的反应条件下,RBD# 4L比RBD# 3L保持了更强健的侧枝活性。这表明RBD# 4聚U亲和性促进了有效的侧枝切割。
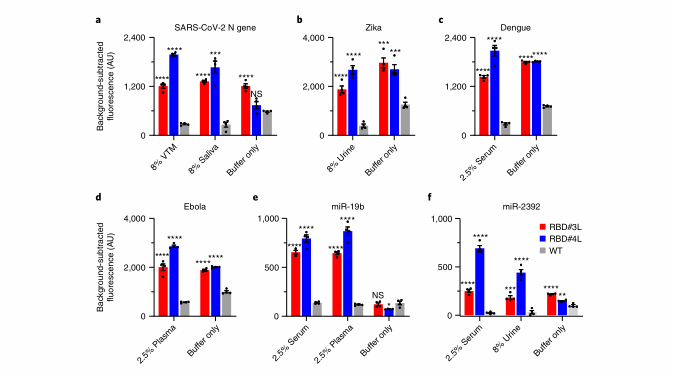
图5 不同靶标的检测
06超灵敏和无扩增RNA检测
为了证明RBD# 3L和#4L可以用于病毒感染的现场诊断,作者将它们的靶激活侧枝切割反应集成到网印电极(SPE)设备中。使用连续稀释合成SARS-CoV-2 N基因靶标,对cas13 -电化学测定的分析性能进行评估,结果显示WT LwaCas13a的LoD约为1 pM,而RBD# 3L和RBD# 4L系统的LoD可以达到到10am。检测该系统的有效性时,WT的系统无法区分病毒原液样品和空白样品,RBD# 3l和RBD# 4L的系统检测到空白和1am靶标反应RNA之间存在显著差异。作者还比较了WT、RBD# 3L和RBD# 4L系统检测临床SARS-CoV-2样本的性能。作者首先对临床样本进行RT-qPCR定量检测。11个样品为阳性,Cq值在22到34之间,10个样品为阴性。使用电化学传感器与WT、RBD# 3L和RBD# 4L耦合进行测试,RBD# 3L在30分钟内检测出9个阳性样品,RBD# 4L检测出10个阳性样品。RBD# 3L和#4L均未检测出Cq值为34的阳性样品,但RBD# 4L可以检测出Cq值为32的样品。采用RBD# 3L或#4L对10个阴性样本进行检测,均未出现假阳性数据,说明方法的准确性较高。
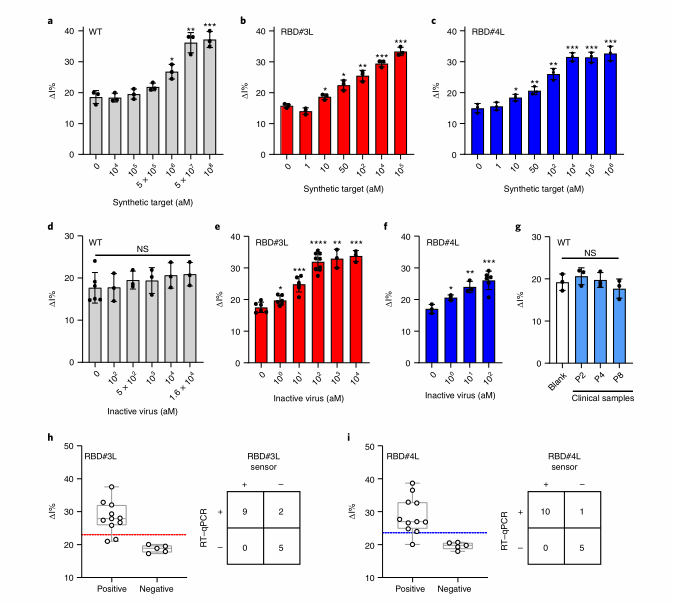
图6 RBD融合有助于在amol下对RNA进行电化学检测
总结通过将不同的RNA结合域插入到其高等真核生物和原核生物核苷酸结合域的独特活性位点-近端环中,获得两种LwaCas13a变体。两种LwaCas13a变体在各种缓冲条件下表现出增强的侧枝活性和提高的敏感性。RBD - LwaCas13a电化学平台具有很高的检测灵敏度和准确性,且不需要额外的RNA提取步骤,在临床和环境重要性的各种RNA的超灵敏检测方面具有巨大潜力。



