【IF 6.2】艾迪基因KO细胞解码SETD7调控TNBC细胞迁移和EMT过程机制
(Su(var)3–9, enhancer of zeste, Trithorax) 结构域含蛋白7(SETD7),是蛋白赖氨酸甲基转移酶(PLMTs)家族的成员,不仅可以甲基化组蛋白,还能够甲基化非组蛋白底物,SETD7的失调已在各种癌症中被观察到,但其在致癌过程中的作用差异很大。有研究发现,SETD7对p53-K372的甲基化提高了p53的稳定性。此外,受SETD7调控的DNA甲基转移酶1(DNMT1)的赖氨酸甲基化与其蛋白酶体降解过程密切相关。然而,YY1甲基化的状态是否会影响泛素化尚不清楚。
近日,上海科技大学高丽丽课题组在Biochimica et Biophysica Acta (BBA) - Molecular Basis of Disease(IF:6.2)上发表了题为SETD7 promotes metastasis of triple-negative breast cancer by YY1 lysine methylation的原创性文章。该研究使用的是艾迪基因的SETD7基因敲除细胞,通过一系列研究阐明了SETD7通过ERK/MAPK信号通路调控TNBC细胞迁移和EMT过程的分子机制。
原文链接:https://doi.org/10.1016/j.bbadis.2023.166780
- 速来get大佬同款!艾迪基因拥有3800+基因编辑现货细胞株,涵盖当前最热门的药物靶点,低至6800!点击查看现货细胞详情
首先作者实验发现乳腺癌组织中的SETD7在TNBC肿瘤组织中的表达水平明显高于肿瘤周围组织。SETD7表达水平的升高与时间呈负相关,此外,对包含132个乳腺癌样本分析显示,与原发肿瘤相比,SETD7转录水平显著升高,作者采用免疫印迹法检测5种TNBC细胞系中的SETD7水平。在MDA-MB- 231细胞中,SETD7的表达相对较高,而在Hs578T细胞中,其表达相对较低,SETD7的表达与TNBC的不良状况相关。
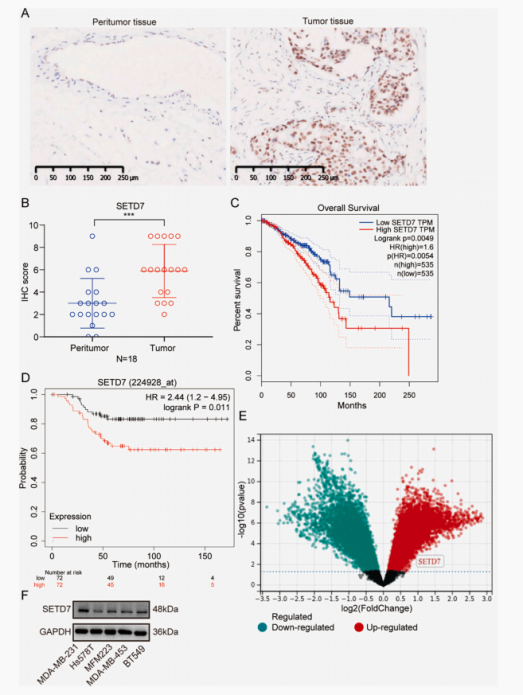
图1. SETD7在TNBC组织中的表达
进一步探究SETD7是否影响TNBC细胞的迁移,作者在MDA-MB- 231细胞和Hs578T细胞中做了沉默表达SETD7和过表达SETD7实验。通过transwell实验和伤口愈合实验来研究SETD7是否对细胞迁移有影响。与NC组相比,过表达SETD7显著增强了这两种TNBC细胞系的细胞迁移。为了探索SETD7影响TNBC迁移的潜在机制,通过测序和蛋白免疫印迹实验证明过表达SETD7促进了TNBC的迁移,而EMT可能是由ERK/MAPK信号通路介导的。
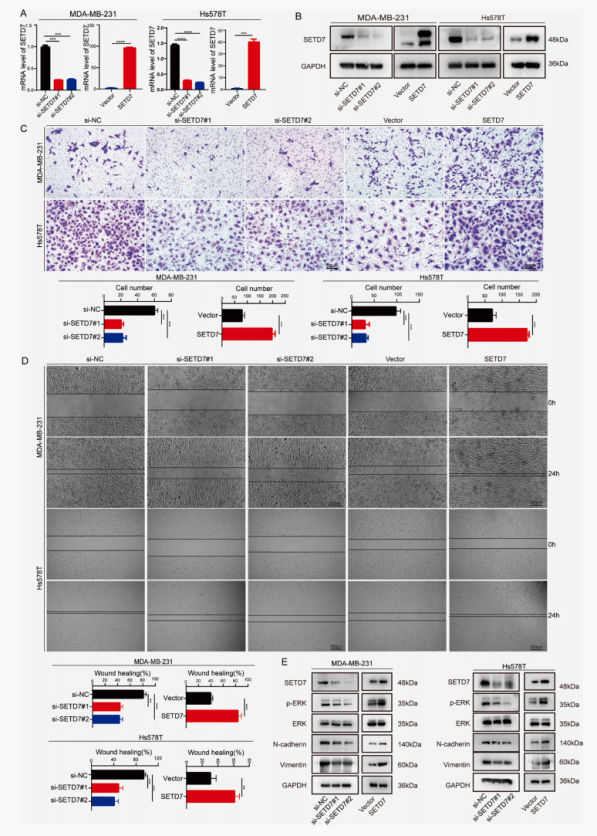
图2. SETD7的表达影响TNBC细胞的迁移
进一步探究SETD7/YY1/MAPK轴可以调节TNBC中的细胞迁移和EMT过程,作者用SETD7-KO或SETD7-OE对TNBC细胞进行的蛋白免疫印迹实验显示,SETD7翻译调控YY1的表达,而不转录。通过CO-IP/western印迹,我们发现SETD7和YY1之间没有很强的相互作用。由于非组蛋白的赖氨酸残基甲基化可以增强蛋白的稳定性,我们推断setd7介导的YY1甲基化是其表达改变的原因。通过进一步实验发现YY1在SETD7-KO细胞中的稳定性降低,但在SETD7-OE细胞中受到的影响较小。SETD7-KO细胞中多聚泛素化的YY1水平较高。证实SETD7介导的YY1泛素化修饰调控其蛋白表达水平和稳定性。
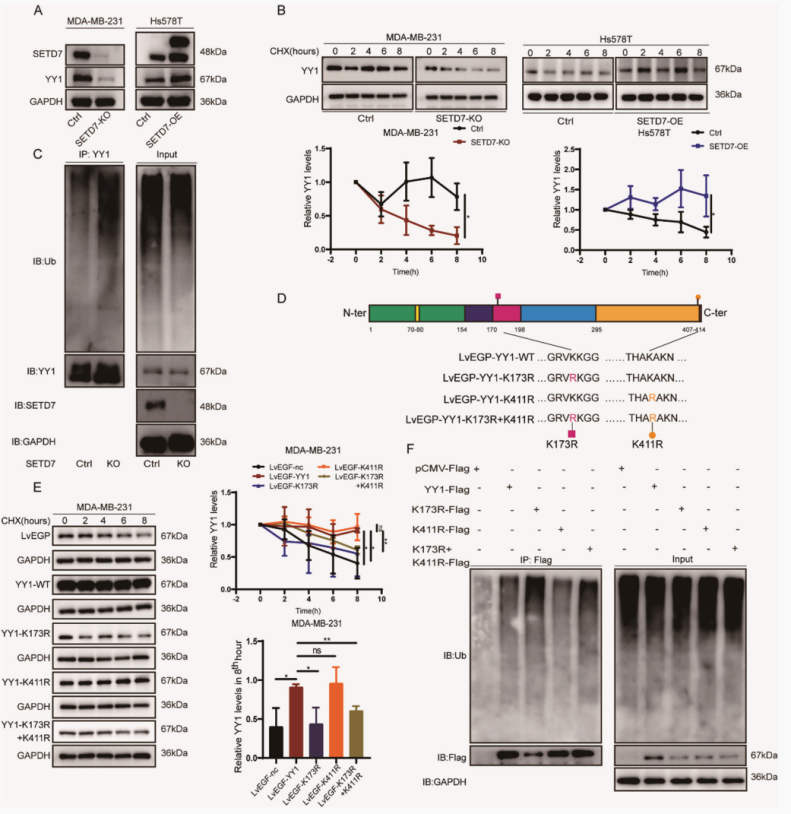
图3. YY1基因可以恢复SETD7-KO细胞中的TNBC迁移和EMT表达
为了探究SETD7是否调控TNBC细胞的迁移,EMT是否依赖于YY1,作者在含有SETD7-KO的TNBC细胞中过表达YY1,并在含有SETD7-OE的细胞中敲除YY1。实验结果表明,在没有SETD7的情况下,在MDA-MB-231细胞中,YY1恢复了细胞迁移,而在过表达SETD7的Hs578T细胞中,YY1-KD破坏了细胞迁移,此外,在SETD7-KO细胞中过表达YY1恢复了ERK/MAPK通路和EMT,但YY1-KD抑制了SETD7-OE诱导的ERK/MAPK通路和EMT。
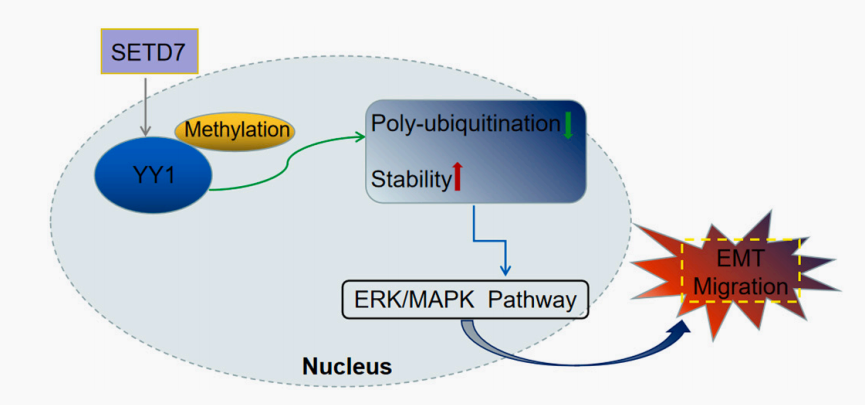
图4. SETD7通过YY1/ERK/MAPK通路增强TNBC EMT迁移示意图。
综上研究结果表明,SET/YY1/ERK/MAPK通路在诱导TNBC细胞的迁移和EMT过程中发挥了重要作用。
学习大佬思路!对细胞进行敲除+过表达验证实验结果!艾迪基因提供敲除细胞定制、稳转株构建服务,买三送一,KO细胞定制低至8开头!点击查看活动详情>>>
相关资讯:
利用CRISPR文库筛选技术,解码癌细胞触发γδT细胞检测新途径>>
18102225074(微信同号)
market@edgene.cn



