【本月之星】GLP1R、CTNNB1、PKM基因敲除细胞
基因敲除是研究基因功能最有效的策略之一,通过对比敲除后细胞表型、功能和结构的变化来研究该基因的生物学功能。艾迪基因贴心的为大家推荐本月最畅销的三款基因敲除细胞,并附上该细胞相关研究文献解读,希望能为大家的科研道路添砖加瓦。
一、GLP1R基因敲除细胞
原文链接:https://doi.org/10.1016/j.molmet.2016.06.006
肠内分泌激素胰高血糖素样肽1 (GLP-1)是一种有吸引力的抗糖尿病药物,可在胰腺α细胞中降低胰高血糖素的分泌,在胰腺β细胞中促进胰岛素的分泌,降低食欲,减缓胃部排空,在心血管系统中还能提高心率,增加心输出量。GLP1R基因编码的蛋白质包含130个氨基酸长的细胞外结构域(ECD),该结构域结合GLP-1的C末端螺旋部分,启动了肽受体的相互作用。
本研究培育了一株重组乳酸乳球菌(Lactococcus lactis,GLP-1)用以提高小鼠在高脂饮食(HFD)下的糖耐量的能力,将L.lactis FI5876分别用空载体(pUK200)和小鼠GLP-1表达载体(鼠GLP-1表达载体)转化产生LL-uk200和LLGLP1,并使用GLP1R基因敲除小鼠的原代胰岛细胞和野生型小鼠的原代胰岛细胞检测其诱导胰岛素分泌的能力。结果显示GLP1R基因敲除胰岛细胞不受LL-uk200和LLGLP1的影响,胰岛素释放不增加;野生型细胞受LL-uk200和LLGLP1的影响提高了葡萄糖耐量,并增加胰岛素水平。该研究证明一株经基因修饰的乳酸乳杆菌可以产生GLP-1,刺激离体小鼠胰岛的胰岛素分泌,并改善小鼠的糖耐量,GLP1R基因敲除实验验证该基因在提高胰岛素水平,改善机体葡萄糖耐量中有重要作用,为对抗糖尿病提供新的思路。
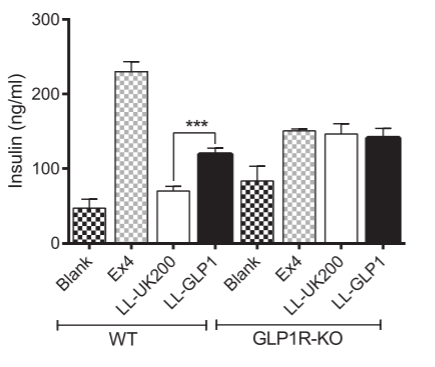
图1 LL-uk200和LLGLP1对野生型细胞和GLP1R敲除细胞胰岛素分泌影响
二、CTNNB1基因敲除细胞
原文链接:https://doi.org/10.1016/j.jhep.2018.09.023
WNT/b-Catenin(CTNNB1)是胆道损伤模型中的一个可调节靶点,异常激活会导致结直肠癌、乳腺癌、肝癌和黑色素瘤等各种癌症疾病的发生。卟啉症是血红素生物合成酶异常导致有毒副产物卟啉的积聚引起的疾病,通常会导致肝胆损伤、光敏感和精神神经症状,并导致肝硬化和肝细胞癌。
本研究使用3,5-Diethoxycarbonyl-1,4-dihydrocollidine(DDC)引起卟啉中间体的积累来模拟卟啉症。向CTNNB1基因敲除小鼠和健康小鼠投喂DDC,另一组健康小鼠投喂正常食物作为野生型对照,两周后分别取三组小鼠的肝细胞进行分析。研究发现与对照组相比,DDC喂养的CTNNB1基因敲除小鼠肝细胞基本不存在卟啉的积聚和沉积,并减少了内质网应激和自噬。值得注意的是,研究人员发现了一个关键的血红素生物合成酶网络,该网络在CTNNB1基因缺失时受到抑制,防止有毒的原卟啉积累。结果表明,敲除CTNNB1基因能有效减少卟啉的积聚,改善了蛋白酶体的活性,减轻卟啉症对肝脏的损伤。
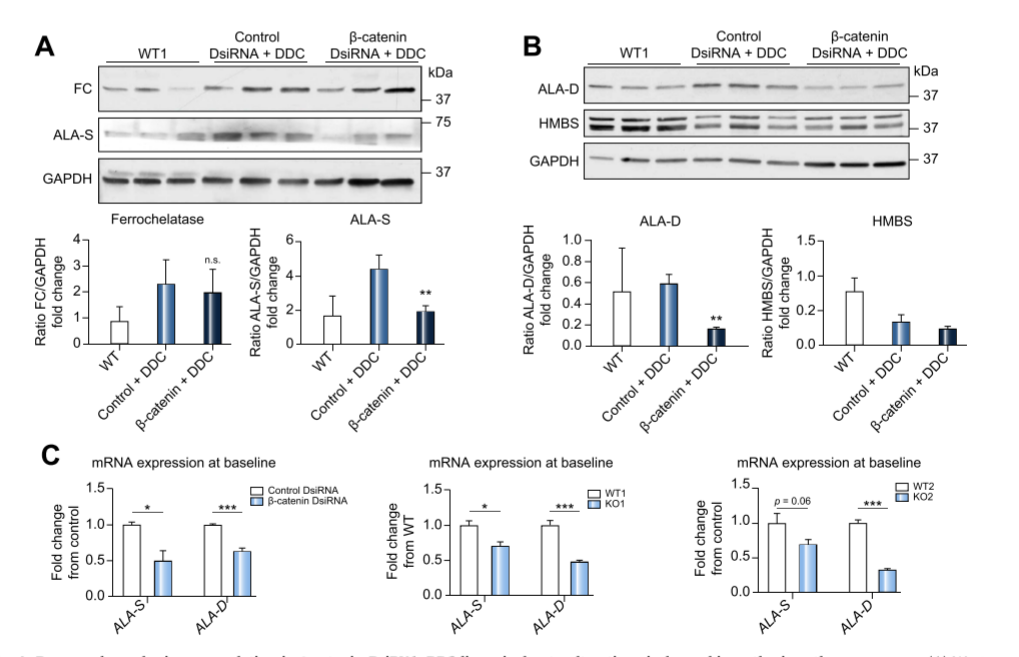
图2 CTNNB1基因敲除减少有毒副产物卟啉的积聚
三、PKM基因敲除细胞
原文链接:https://doi.org/10.1002/btpr.3193
中国仓鼠卵巢(CHO)细胞通常用于生产治疗性蛋白,CHO细胞糖酵解过程中在某些条件下会分泌乳酸使培养基酸化,不利于细胞自身生长。为避免该现象降低细胞产率,人们设计了很多优化策略,如操纵糖酵解或乳酸生成途径中的乳酸脱氢酶、丙酮酸脱氢酶激酶和丙酮酸激酶等。Pyruvate kinase muscle(PKM)基因是丙酮酸激酶表达的关键基因之一,编码产生PKM1和PKM2异构体,与糖酵解和乳酸生成过程关系密切。
本研究使用野生型(WT)和分别敲除PKM基因和PKM1基因的中国仓鼠卵巢细胞(CHO)来研究该基因对乳酸分泌的代谢变化的影响。在14天的分批喂养生产试验中,与WT细胞相比,PKM-KO和PKM1-KO细胞每个细胞消耗更多的葡萄糖,改变了氨基酸代谢,有更高的丙酮酸进入三羧酸(TCA)循环的通量,且乳酸的分泌水平降低,具有更高的特异性生产力和更低的细胞生长速率。实验结果表明删除PKM或PKM1能降低CHO细胞的生长,提高细胞的特异性生产力,使细胞拥有更好的效价。
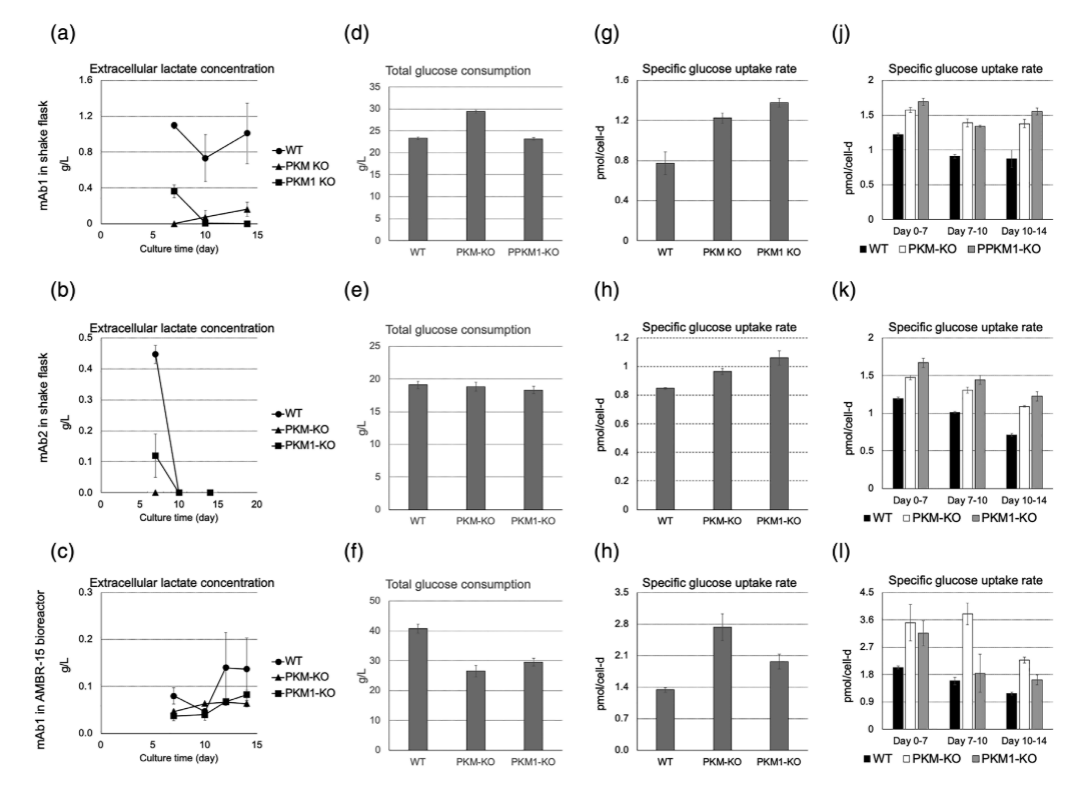
图3 PKM和PKM1敲除细胞乳酸生成量减少,葡萄糖消耗增加
敲除细胞系购买请认准基因编辑专家——艾迪基因,库存3800株基因敲除细胞现货,为您提供上述GLP1R基因敲除细胞、CTNNB1基因敲除细胞、PKM基因敲除细胞现货,满足您的科研需求,现在下单快递一周送达,仅需6800元起!
联系我们
18102225074(微信同号)
market@edgene.cn
近期资讯
【前沿资讯】基因编辑新动向-敲除细胞、先导编辑点突变技术照亮基因研究之路
【干货分享】Prime editing 101:一文带你读懂先导编辑



